
Foto di Dan Cristian Pădureț via Unsplash
TEORIA CINETICA / 3
Come utilizzare l'agitazione delle particelle per ridurre l'inquinamento
Sfruttare la coagulazione - quando due particelle che si toccano ne formano una e la particella somma delle due continuerà a muoversi con massa somma delle due - per ridurre le sostanze indesiderate
Avrei voglia di parlarvi di tante cose, dei resti romani vicino a Coimbra, di come il mondo sarebbe diverso se Putin ascoltasse la musica di Glinka (che da giovane ha studiato a Milano), di come l’astrofisica sta cambiando la posizione dell’uomo nell’universo. Spero ci sarà tempo per tutto questo e altro ancora. Ma ora, per continuità, vorrei proseguire nel ragionamento sulla fisica dell’aerosol e come essa entri nella nostra vita, nelle scelte individuali e collettive. Un mini-corso di fisica del quotidiano, per ridurre l’inquinamento dell’aria e, alla fine, vivere meglio.
Per chi non mi avesse seguito nelle “puntate” precedenti ripeto che quello delle particelle sospese in un gas è un mondo di combinazione e sintesi dei due ambiti. Lo inquadriamo scegliendo due parametri essenziali: la distanza media percorsa dalle molecole fra due urti successivi, da una parte, e una dimensione tipica delle particelle dall’altra. Il rapporto fra questi due parametri (che sono entrambi delle lunghezze) è un numero, il numero di Knudsen, Nkn. Consideriamo ora il regime “molecolare”: le particelle sono così piccole che quasi potrebbero essere considerate loro stesse come delle enormi molecole, abbastanza grandi tuttavia da essere osservabili, non certo a occhio nudo ma sempre con l’aiuto del microscopio, ottico e anche elettronico. E qui dobbiamo parlare di un botanico inglese, Robert Brown che entra prepotentemente nella storia della fisica scoprendo un fenomeno, nel 1827, appena dopo l’entrata in uso dei primi obiettivi acromatici. Brown osservò al microscopio che piccole particelle in acqua (vedremo che sarà più facile osservarle in acqua che in aria) anziché cadere per gravità erano animate da movimenti molto vivi e molto disordinati: un moto incessante che non trovava mai quiete. Osservò questi moti in tutti i fluidi, ma tanto più attivi erano i moti quanto meno viscosi erano i fluidi. Buffon e il nostro Spallanzani, molto prima di Brown, erano a conoscenza del fenomeno, ma non erano stati in grado di comprenderne la natura e pensavano si trattasse di animaletti sub-microscopici. Tornando a Brown, lui osservò che, dato un fluido, la dimensione delle particelle contava molto: l’agitazione era tanto maggiore quanto più piccole erano le particelle. Nei decenni successivi alla sua scoperta si sono moltiplicate le osservazioni. Si è visto che la natura chimica o composizione delle particelle non conta; si agitano allo stesso modo purché abbiano le stesse dimensioni. Il moto non si arresta mai, lo si osserva per mesi o anni, eterno e spontaneo, purché rimanga anche una sola particella sospesa. Ma ecco che con quanto sappiamo del regime “molecolare” (Nkn maggiore di uno) abbiamo una spiegazione immediata del fenomeno. Ogni particella, urtata senza posa dalle molecole vicine, riceve degli impulsi che però non si equilibrano e la particella viene sballottata di continuo da questo non equilibrio. Gli urti sono tantissimi nell’unità di tempo, ma non così tanti da dare equilibrio e tenere la particella ferma. Non c’è una causa esterna per spiegare questa agitazione, e si deve ricorrere a questa “congettura mentale” sulle molecole e loro urti sia con la particella che fra loro.
Un critico acuto, e già introdotto in fisica, si potrebbe chiedere: ma questa agitazione continua non è in contraddizione col principio di conservazione dell’energia? No perché a ogni aumento della velocità della particella si accompagna il “raffreddamento” del gas nelle sue vicinanze, e ogni rallentamento di essa è accompagnato da un “riscaldamento” del gas che la contorna. Si possono dire tante cose su questo, ed Einstein stesso nel 1905 riuscì a dare del fenomeno una teoria anche quantitativa. E’ stata fatta un’ipotesi (congettura mentale) che mette l’agitazione molecolare all’origine del moto browniano. Ma poi sono seguite abbondanti prove sperimentali di conferma della teoria e da questa verrà un grande contributo al problema pratico che ci interessa cioè ridurre l’inquinamento: come fare a separare la particella dal gas che la ospita.
Abbiamo detto che il moto browniano è eterno, ma le sue conseguenze sono rilevanti e sono dipendenti dal tempo. Questa sua singolare caratteristica non è marginale, ma fondamentale, proprio al fine della separazione della particella dal gas. Quali aspetti di questo fenomeno eterno sono dipendenti dal tempo? Sono due. Ricordiamo che quando una particella tocca una superficie estranea rimane aderente a essa per le forze di adesione già descritte (di Van der Waals). Quindi nel moto incessante una particella può incontrare la parete del recipiente o un’altra particella. Nel primo caso l’aerosol interno perde un membro, e continua il moto incessante delle particelle restanti. Nel secondo caso due particelle che si toccano ne formano una e la particella somma delle due continuerà a muoversi con massa somma delle due. Questo secondo processo si chiama coagulazione.
Mettiamo dunque a fuoco del microscopio la celletta di vetro che contiene la sospensione delle particelle. Seguiamo per esempio una particella di mezzo millesimo di millimetro: segnando la sua posizione ogni 30 secondi troveremmo un grafico come questo.
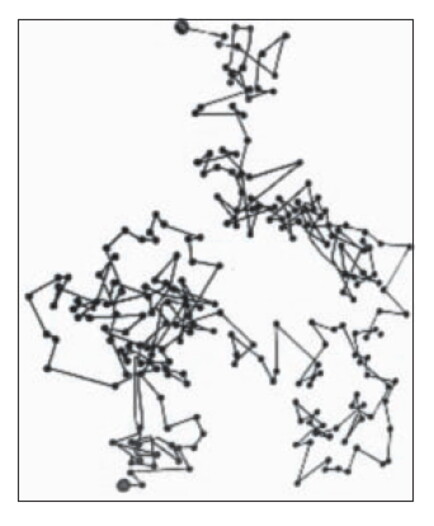
E se osservassimo le posizioni a intervalli di tempo più ravvicinati (ad esempio ogni secondo) troveremmo un tracciato poligonale ancora più frastagliato.
La teoria completa è più complicata ma mi preme ora fare osservare che attraverso i movimenti delle particelle che si vedono si arriva a conoscere proprietà delle molecole che non si vedono. Così si è arrivati a sapere quanto vale il numero di Avogadro. Prima si sapeva solo che esisteva. Osservando il moto browniano si è potuto trovare il valore di questo numero: 6,06 per 10 alla ventitreesima potenza.
Quando invece mettiamo a fuoco la parete interna, le particelle che toccano la parete vi rimarranno aderenti e le vedremo ferme; col passare del tempo le particelle ferme cresceranno in numero. Se facessimo fotografie successive mostreremmo che le particelle si diffondono (la chiamiamo diffusione browninana) verso la parete e il numero di particelle che vanno a incollarsi cresce nel tempo. Anche la cattura reciproca delle particelle che abbiamo chiamato coagulazione dipende ovviamente dal tempo ed entra nella riduzione dell’inquinamento, ma solo nella diminuzione della loro concentrazione e nello spostamento delle loro dimensioni verso le classi più grandi.
Ci fermiamo qui, per ora, riassumendo che abbiamo una diminuzione del numero delle particelle per cattura su superfici esterne o per cattura reciproca. Servendoci della nostra metafora, dello stesso divario di dimensioni fra particelle sospese che si ha fra una formica e una mongolfiera, siamo stati dalla parte della formica (regime molecolare). Uno alla volta vedremo gli altri meccanismi, nel regime viscoso (dalla parte della mongolfiera) e nel regime intermedio, con le dimensioni fra le due. Alla prossima.

Cattivi scienziati
Perché ridiamo? Una risposta e un nuovo libro


redazionale


